Stoffwechsel des Menschen
Wie bei den Pflanzen können die Bedingungen des Lebens (Wachstum, Fortpflanzung und Vermehrung, Stoffwechsel, Reizbarkeit (Reiz- aufnahme, -leitung, -beantwortung), Bewegungsfähigkeit) auch bei Tieren nur auftreten, wenn Stoffe von außen zugeführt werden, also eine Wechselbeziehung zur Umwelt besteht.
Während bei der Pflanze die aufgenommenen Stoffe einfache anorganische Moleküle sind (H2O, CO2) werden bei Mensch und Tier organische Stoffe aufgenommen.
Man nennt diese Ernährungsweise heterotroph im Gegensatz zur autotrophen Ernährungsweise der Pflanzen. Als Nährstoffe werden von Mensch und Tier benötigt:
- Kohlenhydrate
- Fette
- Eiweiße/ Proteine
- anorganische Salze (Mineralstoffe oder Spurenelemente)
- Wasser
- Vitamine
zu 4. Die wichtigsten Ionen sind
Na, K, Ca, Mg, S, B, Cl, Fe, Fe, Cu, Zn, Mn, Co, Mo, J, F, Si
Vitamine
Vitamine sind für den Ablauf von Lebensvorgängen nötig und sind in kleinen bis kleinsten Mengen nötig. Ihr Name wurde gebildet aus Vita (Leben) und amin, da man dachte allen Aminen liegen die chemische Struktur eines Amins zugrunde, dies ist nicht der Fall.
Ihre Wirkung ist katalythischer Natur. Sie sind entweder selbst Co- enzyme oder werden selbst zum Bilden von Co- enzymen benötigt. Der Vitaminbedarf hängt vom Alter, der Art der Ernährung der körperlichen und geistigen Beanspruchung und von Gesundheitszustand ab. Der bedarf ist in jugendlichem vorgerückter Alter, bei schwerer körperlicher Arbeit und bei vielen Erkrankungen besonders groß. Der Tagesbedarf eines Menschen liegt für alle Vitamine unter 10 mg mit Ausnahme von Vitamin C, von dem 75 mg pro Tag benötigt werden. Dauernder Vitaminmangel für zu ausgesprochenen Vitaminmangelkrankheiten, den sogenannten Amitaminosen (Buch S.176 Tabelle).
Heute kommen solche Amitaminosen kaum noch vor. Es gibt fettlösliche und wasserlösliche Vitamine, dies weist darauf hin, dass der Mensch zur vollständigen Ernährung auch Fett aufnehmen muss.
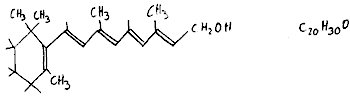
Vitamin A
Vorkommen und Mangelkrankheiten: siehe Buch
Es wird auch Retinol genannt und hat folgende Formel: siehe (noch)
Buch
Vitamin A ist fettlöslich und die empfohlene Tagesration
liegt bei 1,2- 1,5 mg
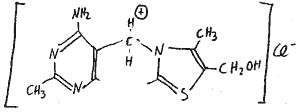
Vitamin B1: Thiamin
Thiamin besteht aus Hetrocylen: Pyramidin- und Diazolring
Vitamin C: Ascorbinsäure
Ist ein Abkömmling der Zucker
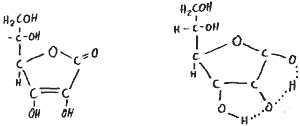
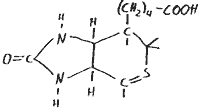
Vitamin D: Calciferol
- besteht aus vier Ringsystemen mit zum Teil konjugierten Doppelbindungen und einer daranhängenden, verzweigten Kette
Vitamin E: Tocoferol
- gehört zur Gruppe der fettlöslichen Vitamine
- chemische Strukturformel ähnlich der des Vitamin D
- findet sich reichlich in Weizenkeimöl und anderen pflanzlichen Ölen
- wichtig für: Stoffwechsel und Aufbau von Hormonen
- Tagesbedarf: ca. 1 mg
Vitamin F
So werden die essentiellen Fettsäuren bezeichnet. Als solche werden die Fettsäuren der Linolsäurereihe, d.h. Fettsäuren mit 3- 4 Doppelbindungen und einer Kettenlänge von 18 C- Atomen. Diese befinden sich in pflanzlichen Ölen und sind wichtig für den Aufbau der Haut, der Schleimhäute, Kontrolle des Wasserhaushaltes, Fortpflanzungsorgane und Hormone. Tagesbedarf: 6- 8 mg
Vitamin H: auch Biotin genannt
Gehört zu der Gruppe der Wuchsstoffe. Es reguliert das Embrionalwachstum, sowie das plasmatische Wachstum. Außerdem wichtig für die normale Funktion der Haut. Tagesbedarf: 2 mg
Vitamin K: Phyllochinon
- wichtig für den Aufbau des blutes/ Blutgerinnungsfaktor
- befindet sich ebenfalls in pflanzlichen Ölen wird aber auch von Bakterien im menschlichen Darm produziert
- daher kein bis geringer Tagesbedarf>
Enzyme
Eine wichtige Stoffgruppe, die beim Stoffwechsel beteiligt sind, sind
die Enzyme. Einzelne werden vom Körper selbst produziert und sind
Biokatalysatoren. D.h. sie katalysieren alle Stoffwechselreaktionen
im Körper, ermöglichen oder beschleunigen diese Reaktion und
gehen selbst aus der Reaktion ungeändert hervor. Die Gesamtheit
des Stoffwechsels wird durch sie gesteuert. Enzyme wurden auch früher
als Fermente bezeichnet (dieser Ausdruck ist veraltet).
Die Enzyme sind in der überwiegenden Mehrzahl entweder Proteine,
daher Proteoenzyme genannt (Pepsin,Trypsin) oder Proteidenzyme (Proteide
sind große Proteine mit Fremdatomen oder Fremdgruppen).
Daneben gibt es einige wenige Riboenzyme, d.h. Enzyme deren Molekül
aus einer kurzen Ribonukleinsäure besteht.
Ein Enzym (Holoenzym) setzt sich meist aus zwei Teilen zusammen: dem Co-enzym und dem Apo-enzym. Erst wenn sich beide Teile zusammensetzen kann das Enzym wirken. Das Co-enzym wird meist als Prostetische Gruppe bezeichnet. Die Prostetische Gruppe ist gegenüber dem Proteinanteil ein kleines Molekülteil. Häufig bilden das Gesamtco-enzym oder ein Bestandteil. Im Gegensatz zum Proteinanteil wird das Co-enzym bei der Reaktion verändert, entspricht also nicht der Definition eines Katalysators. Erst in einer Zweitreaktion wird das Co-enzym wieder regeneriert.
Heute unterscheidet man doch zwischen Co-enzym und Prostetischer Gruppe. Dabei werden als Co-enzyme solche Gruppen bezeichnet, die bei der Reaktion leicht abspalten, sich verändern und erst später wieder regenerieren und an das Apo-enzym wieder zurückgehen. Sie werden auch als Co-substrate bezeichnet.
Die Prostetische Gruppe ist nicht leicht von Apo-enzymen abzutrennen, sie bleibt während der Reaktion fest am Apo-enzym gebunden. Dabei verändert sich auch diese Prostetische Gruppe, während der ersten Reaktion, die das Gesamt-enzym unternimmt., erhält aber seine ursprüngliche Gestalt durch eine zweite Reaktion des Gesamt-enzyms wieder zurück.
Einteilung der Enzyme
Die Enzyme werden in 6 Gruppen unterteilt und zwar nach dem Reaktionstyp, den sie katalysieren.
- Oxidoreduktasen (Enzyme, die biologische Oxidation und Reduktion katalysieren)
- Ligasen (Enzyme, die unter Spaltung von ATP neue Bindungen herstellen)
- Transferasen (Gruppenübertragende Enzyme)
- Hydrolasen (Enzyme, die Bindungen spalten unter Wasseranlagerung)
- Isomerasen(Enzyme, die innerhalb eines Moleküls Umlagerungen steuern, also Isomere bilden)
- Lyasen (Enzyme, die die Ausbildung von Doppelbindungen, oder die Addition an Doppelbindungen bewirken)
- Der genaue Name eines Enzyms wird so hergestellt:
- vorne steht der Name des Stoffes, auf den es einwirkt
- in der Mitte erfolgt die Bezeichnung des Reaktionstyps
- daran kommt die Endsilbe –ase
- Eine zweite Möglichkeit der Benennung verwendet lediglich den Namen des Substrates, das durch das Enzym zerlegt wird und die Endung -ase
Bsp. für
- Aminosäurendecarboxilase
- Aminotransferase
Die Wirkweise der Enzyme
Die Enzyme sind in zweierlei Weise tätig und spezifisch:
- Sie besitzen eine Substratspezifität und
- eine Wirkspezifität.
Erstere entscheiden welche Stoffe umgesetzt werden, oder nicht. Letztere entscheidet, welche von den zahlreichen möglichen Versionen am Substratmolekül vollzogen wird, also über die Reaktionsart.
Im Apoferment wird vor allem die Substratspezifität bestimmt, durch das Coferment word vor allem die Wirkungsspezifität bestimmt. Das Ausmaß der Substratspezifität ist von Enzym zu Enzym unterschiedlich. Manche reagieren verhältnismäßig unspezifisch mit ganzen Gruppen von Molekülen (Substratgruppen), andere ausschließlich und spezifisch nur mit einem Substrat.
Schließlich treten auch Isoenzyme auf. Diesen Enzymen, die zwar die gleiche Reaktion katalysieren, aber eine unterschiedliche, genetisch bedingte Aminosäurestruktur besitzen, sie lassen sich daher mit Hilfe der Proteinchemie (ZB, Elektroforese) leicht voneinander trennen. Sie unterscheiden sich nur in ihren Funktionen nämlich:
- dem Zeitpunkt und
- der Regulation der Aktivität.
Darin liegt auch die biologische Funktion der multiplen Formen.
Für die katalytische Wirksamkeit eines Enzyms ist das aktive Zentrum zuständig, dass nur aus bestimmten Teilen der Gesamtpolipeptidgruppe gebildet wird und durch seine bestimmte Faltung, d.h. durch seine räumliche Struktur, wirkt. Da diese Faltung bei Hitze- oder Säureeinwirkung zerstört wird entfällt dadurch die katalytische Wirkung, obwohl die Aminosäuresequenzen erhalten bleiben. Man nennt dies Denaturation.
Bedingungen der Enzymaktivität
Für die Aktivität eines Enzyms sind zwei Faktoren von ausschlaggebender Bedeutung:
- das pH- Optimum, also ein optimales Ionenmilieu und
- die Temperatur
Ein dritter Faktor, wenn auch weniger stark, bildet das substrat selbst, nämlich durch die Menge in der es vorliegt. Schließlich benötigen manche Enzyme zusätzlich bestimmte Ionen durch die sie aktiviert werden (Aktivatoren), andererseits gibt es bestimmte Ionen oder Ionengruppen (Cyanitkomplexe oder Schwermetallkomplexe), die sich an das aktive Zentrum binden können, so dass diese irreversibel besetz ist.
Die Aktivierung des Enzyms wird dadurch vollständig und irreversibel unterbunden. Man nennt dies auch Vergiftung der Enzyme. Neben dieser irreversiblen Wirkung tritt auch eine reversible Wirkung auf, die durch andere Stoffe hervorgerufen wird. Dies nennt man eine Hemmung von Enzymen. Es gibt folgende Hemmungsmechanismen:
zu 1. competition (Wettbewerb)
Bei dieser Hemmung wird das Enzym dadurch in seiner Wirkung gehindert,
dass ein anderer Stoff vorliegt, der dem Substrat in chemischem Aufbau
ähnelt und daher mit diesem in Konkurrenz um das binden an das
aktive Zentrum des Enzyms tritt. Dadurch wird nicht mehr das Substrat
selbst alleine umgesetzt, sondern auch dieses andere organische Molekül.
Je höher die Konzentration dieses Stoffes, desto größer
die Hemmung.
zu 2.
Hier wird ebenfalls ein strukturell verwandtes Moleküle, Hemmstoff
genannt, an das aktive Zentrum gebunden. Seine Bindung ist allerdings
nicht irreversibel, sondern es löst sich nach kurzer Zeit wieder
von selbst. Dadurch kann nach einiger Zeit auch das Substrat gebunden
werden. Insgesamt ist der Reaktionsverlauf aber stark verzögert.
zu 3.
Bei manchen Reaktion reagieren manche Enzyme bei hohen Substratkonzentrationen
langsamer und zwar lagern sich hier mehrere Substratmoleküle gleichzeitig,
aber nicht vollständig an das aktive Zentrum an und behindern sich
dadurch bei einer vollständigen Reaktion.
zu 4. Auch bei der Produkt-Hemmungen wird eine Verlangsamung der Reaktionsgeschwindigkeit hervorgerufen und zwar mit der Zunahme des entstehenden Produktes. Dies wird dadurch hervorrufen, daß das entstehende Produkt eine ähnliche Struktur aufweist, wie das Substrat und sich daher mit diesem um die Bindung am aktiven Zentrum konkurriert.
zu 5.
Hierbei wird ein Nichtsubstratmolekül an einen anderen Ort außerhalb
des aktiven Zentrums des Enzyms gebunden. Dadurch wird allerdings die
räumliche Faltung so geändert, daß die Bindung des Substrats
erschwert oder völlig verhindert wird.



